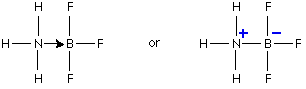پیوند کووالانس کئوردینانس (داتیو)
هریک از دواتم شرکت کننده در پیوند کووالانسی یک الکترون به اشتراک می گذارند. وبه طوری که نمی توان تشخیص داد که الکترون های پیوندی متعلق به کدام اتم بوده است .ولی یک نوع پیوند کووالانسی دیگروجود دارد٬که درآن یک اتم دوالکترون پیوندی ( دهنده الکترون ) راتامین می کند واتم دیگر که الکترون کم دارد (پذیرنده الکترون) این دوالکترون را می گیرد .این پیوندکووالانسی را داتیو ( کووالانس کئوردینانسی ) می نامند.
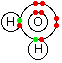
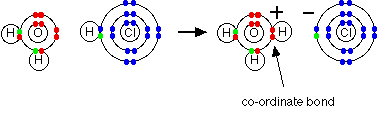
هنگامی که گاز آمونیاک را باگاز هیدروژن کلرید مجاور هم قرار می دهیم این دو ماده باهم واکنش داده ومولکول NH4Cl را می سازند که از یون کلرید( -Cl ) ویون آمونیوم ( +NH4 ) تشکیل شده است .
همانطور که ملاحظه می نمایید H درمولکول HCl الکترون خودرا درلایه الکترونی اتم Cl جا می گذارد واتم نیتروژن درمولکول NH3: الکترون غیر پیوندی خودرا دراختیار+ H قرار می دهد.به این ترتیب + H پذیرنده الکترون واتم نیتروژن درمولکول NH3 دهنده الکترون می باشد.
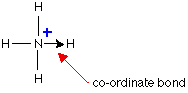
به طور ساده می توان پیوند داتیورا به صورت یک فلش از طرف عنصر دهنده الکترون به سمت اتم گیرنده الکترون نشان داد درضمن باید توجه داشت هرچهار پیوند در یون آمونیم ازنظر انرژی وطول پیوند یکسان هستند وهیچگونه تفاوتی بعد ازتشکیل باهم ندارند.
هنگامی که مولکول HClدرآب حل می شود + H از این مولکول جداشده وبامولکول آب پیوند داتیومی دهد دراین جانیز اتم اکسیژن آب که دوجفت الکترون ناپیوندی دارد یک جفت الکترون دراختیار+ H قرارمی دهد وپیوند داتیو تشکیل می شود
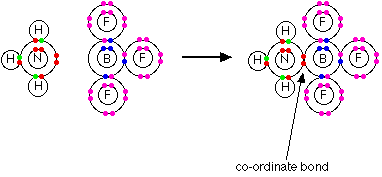
به واکنش زیر توجه کنید .دراین واکنش نیتروژن جفت الکترون ناپیوندی خودرا دراختیار اتم بور قرار می دهد وبه این ترتیب اتم بور B نیز درلایه ظرفیت خود دارای هشت الکترون می شود.
به شکل ساده تر بامدل خطی می توان این مولکول را به صورت زیر نشان داد.
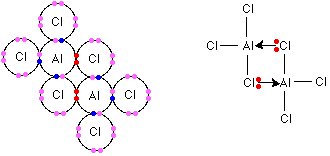
مولکول 3 AlCl نیز مانند مولکول 3 BF می باشد واتم Al دراین مولکول درلایه ظرفیت خود دارای شش الکترون می شود . آزمایش نشان می دهد این مولکول در 180 درجه سانتی گراد تصعید می شود. اگر این ماده ساختار یونی می داشت باید دمای ذوب بسیار بالایی می داشت . زیرابرای ازبین بردن جاذبه شدید بین یون ها به انرژی زیادی نیاز است .
وقتی ماده ای دردمایی پایین تصعید می شود. می توان نتیجه گرفت بایدمولکولی کووالانسی باشد .( جامد مولکولی ) به مدل الکترون نقطه ای 3 AlCl توجه کنید.
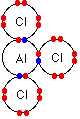
اندازه گیری جرم مولکولی درحالت بخار این مولکول نشان می دهد فرمول مولکولی آن باید به صورت دیمر ( Al 2Cl6 ) باشد .دراین دیمر همانطور که درزیر ملاحظه می کنید . دو پیوند به طریق داتیو تشکیل شده است .
اتم کلر نیزدارای زوج الکترون های غیر پیوندی درلایه ظرفیت خود است که می تواند آن ها رادراختیار اتم Al قراردهد .
پیوند در یون های فلزی آبپوشیده:
مولکول آب باتشکیل پیوندقوی یون های حل شده را احاطه می نماید. بیشتر یون های فلزی ضمن آبپوشی با مولکول آب پیوندتشکیل می دهند.
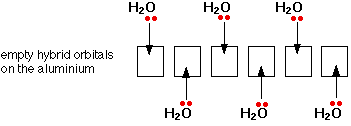
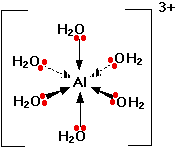
آلومینیم کلرید دارای پیوند کووالانسی است هنگامی که درآب حل می شود یونش می یابد. سپس شش مولکول آب یون 3+Al را احاطه نموده و یون هگزا آکوا آلومینیم Al(H2O)6+3 را می سازند . به چگونگی تشکیل این یون توجه نمایید . Al: 1s22s22p63s23px1
A l +3 : 1s22s22p6
اکنون این یون می تواندبا اوربیتال های ( 3s,3p, 3d) لایه ظرفیت خودبا جفت الکترون های غیرپیوندی
اکسیژن آب پیوند داتیو برقرارنماید. شکل این یون هشت وجهی است( هیبرید S P3d2) .لازم به تذکراست برای تجسم شکل کمپلکس پیوندهای داتیوی که دربالا وپایین صفحه قرار دارندبه شکل فلش های خطی و پیوندهای داتیوی جلوی صفحه بافلش هایی به شکل گوه وپیوندهای داتیوی عقب صفحه به شکل فلش های نقطه چین نشان داده شده است .
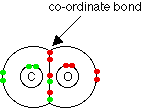
پیوند داتیو درکربن منوکسید
درمولکول کربن منوکسید دواوربیتال تک الکترونی اکسیژن بادواوربیتال تک الکترونی کربن پیوند کووالانسی برقرارمی نمایند .امادراین حالت لایه ظرفیت کربن دارای شش الکترون خواهد شد. برای تکمیل لایه ظرفیت درکربن جفت الکترون غیر پیوندی اکسیژن با کربن پیوند داتیو می دهد . به این ترتیب درفرمول ساختاری کربن منوکسید پیوند سه گانه برقرار می شود. C ≡ O
پیوند داتیو درنیتریک اسید
دربیشتر اسید های اکسیژندار اتم مرکزی با اکسیژن دارای پیوند داتیو است واثر القایی منفی این اکسیژن باعث افزایش قدرت اسیدی دراین گونه اسید ها می شود.
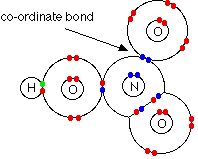
لازم به تذکر است دریون نیترات هرسه پیوند N وO ازهرحیث یکسان هستند واین به علت عدم استقرارالکترون (رزونانس) دراین سه پیوند است .