چگونه یک ساعت سیبزمینی بسازیم!
مقدمه
قبل از پختن، سرخ کردن و خوردن سیبزمینی بهعنوان یک وعدهی شام خوشمزه، شما میتوانید از آن برای یادگیری بخش کوچکی از واکنشهای شیمیایی استفاده کنید. شما میتوانید این کار را از طریق ساخت یک ساعت که روی سیبزمینی انجام میشود اجرا کنید.
چیزهایی که شما به آن احتیاج دارید
-

- دو عدد سیبزمینی بزرگ
-
- دو عدد میخ از جنس روی (گالوانیزه)
-
- دو عدد میخ مسی یا دو تکه سیم مسی
-
- سه عدد سیم اتصال سُربی با طول مناسب
-
- یک عدد ساعت بدون باتری
مرحلههای ساخت ساعت سیبزمینی
1- ابتدا دو عدد سیبزمینی را جدا کنید. هر سیبزمینی بهعنوان یک پیل گالوانیک جریان الکتریکی را از طریق واکنشهای شیمیایی تولید میکند. یکی از این سیبزمینیها را عدد 1 و دیگری را عدد 2 بنامید.
2- دو میخ گالوانیزه را در هر سیبزمینی فرو کنید.
3- سپس یک تکه سیم مسی را در هر سیبزمینی قرار دهید بهطوری که با میخ گالوانیزه زاویه قایم بسازد از طرفی به میخ گالوانیزه هم برخورد نکند.
4- در این مرحله باتری را از ساعت بیرون کنید.
5- سپس سیم اتصال سربی را از یک سر به سیم مسی متصل به سیبزمینی 1 و سر دیگر آن را به قطب مثبت ساعت (قطب مثبت ساعت در محل باتری با علامت + نشان داده شده است) بپیچید.
برای این کار از سیم سربی گیره دار نیز میتوانید استفاده کنید.
6- سیم اتصال سربی دوم را هم بههمین ترتیب از یک سر به میخ گالوانیزه (روی) متصل به سیبزمینی 2، و سر دیگر آن را این بار به قطب منفی ساعت وصل کنید.
که قطب منفی ساعت در محل باتری با علامت – مشخص است.
7- در این مرحله سیم اتصال سربی سوم را از یک سر به میخ گالوانیزه سیبزمینی 1 و از سر دیگر به سیم مسی متصل به سیبزمینی 2 وصل کنید.
در این مرحله هر سه اتصال سربی با هم در ارتباط هستند و ساعت شروع به کار میکند.
8- در پایان ساعت را چک کنید! هم اکنون ساعت با قدرت سیبزمینی شروع به کار میکند.
چه اتفاقی افتاده است؟
در این جا سیبزمینیهای بزرگ بهعنوان پیل کاربرد دارند و آب داخل سیبزمینی هم بهعنوان الکترولیت قادر است اتم و ملکولهای باردار را که اصطلاحا یون مینامند در خود حل و جابهجا کند.
تعدادی از این اتمها و ملکولها بهطور شدیدی الکترونهای اضافی را جذب میکنند و بار منفی میگیرند که آنها را آنیون مینامند. برخی دیگر الکترون از دست میدهند و بار مثبت پیدا میکنند که اصطلاحا کاتیون نامیده میشوند.
آب سیبزمینی که اسیدفسفریک رقیق است، قادر به حل کردن کاتیونهای هیدروژن و آنیونهای فسفات در خود است. و به یونهای +H و -PO4 تفکیک میشود.
دو میخ گالوانیزه و مسی نیز نقش الکترود را در این پیل سیبزمینی بازی میکنند. وقتی که شما الکترود روی و الکترود مس را به سیبزمینی وصل میکنید، فلزی که تمایل کمتری به جذب الکترون نسبت به یونهای هیدروژن داشته باشد یا بهعبارتی پتانسیل کاهش کمتری داشته باشد، ترجیح میدهد الکترون از دست دهد. در اینجا اتمهای روی، دو الکترون از دست می دهند و به Zn+2 تبدیل میشود. یونهای هیدروژن الکترونهایی را که اتمهای روی از دست دادهاند، جذب میکنند و بهصورت مولکول هیدروژن (H2 گازی) در میآیند و از محیط واکنش به صورت حبابهایی خارج میشوند.
از آن جا که این دو الکترود توسط سیم هادی سربی به هم وصل شدهاند، میخ از جنس روی، در نقش آند تعدادی از الکترونها را به سیم مسی یعنی قطب کاتد منتقل میکند. بهدلیل تراکم الکترونهای اضافی در سیم مسی، یونهای هیدروژن الکترونهای آن را جذب می کنند و هیدوژن گازی بیشتری اطراف آن تولید میشود اما تمایل مس به نگهداری الکترونها مانع از خوردگی آن میشود. بیشتر الکترونها در سیم هادی باقی میمانند و یونهای هیدروژن و Zn+2 در کل سیبزمینی پخش می شوند و باعث حفظ طراوت و تازگی الکترولیت اطراف الکترودها می شوند. نیرویی که توسط آن الکترود مس الکترونها را به سمت خود می کشد درست مانند کارکردن ساعت است.
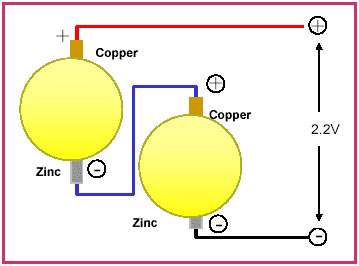
این نوع سیم کشی انتها به انتها ی سیبزمینی، یک نوع مدار سری را تولید می کند که جریانی از الکترونها را با دو برابر نیرو، از سیبزمینی وارد ساعت می کند. اگر چند عدد از سیبزمینیها به صورت سری به یکدیگر وصل شود توان آنها بالاتر می رود و می توان حتی یک رایانه قابل حمل و کوچک را روشن کرد. دانشمندانی که این روش را ابداع کرده اند می گویند این روش می تواند به میلیونها نفر در مناطق فقیر جهان کمک کند تا با هزینه پایینی برق مورد نیاز خود را تامین کنند.
بررسیها همچنین نشان داده است برق به دست آمده از سیبزمینی آب پز ده برابر بیشتر از سیبزمینی خام است. یک باتری سیبزمینی میتواند تا بیست ساعت برق تولید کند که با آن میتوان دستگاههای کممصرف پزشکی و روشنایی را روشن کرد.