نانودارورساني به مغز با اسب تروا(2)
جمعه 1 اسفند 1393 10:10 AM
نانودارورساني به مغز با اسب تروا(2)
توزيع زيستى
نقش سورفاكتانت در توزيع نانوذرات در محيط هاى زيستمند.
مطالعات مهمى كه تروستر و همكارانش در خصوص نحوه توزيع ذرات[نانو پلى متيل متاكريلات] C انجام دادند، ثابت كرد كه روكش كردن نانوذرات با سورفاكتانتهايى معين، باعث ميشود تا بعد از تزريق وريدى، نانوذرات در مغز موش (صحرايى) تجمع پيدا كنند.
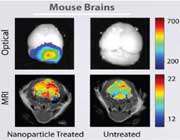
نانوذرات با روكش پلى سوربات 80 تا 3 برابر بيشتر از محلول دالارگين در فضاى همگون مغز تجمع پيدا كردند. نانوذرات روكش شده با پلى سوربات 80 بيشترين غلظت داكسوروبايسين را g/g?) 6 بافت مغز) ظرف مدت 2 تا 4 ساعت درمغز، ايجاد كردند. اين غلظت حتى 8 ساعت بعد از تزريق در حد g/g? 1 باقى ماند، در صورتيكه سه تركيب ديگر در سرتاسر زمان آزمايش حتى غلظتشان به حد قابل تشخيص 0/1 g/g?) ) هم نرسيد. اين 4 محصول اختلاف غلظت ناچيزى را در خون نشان دادند. نكته بسيار جالبى هم در مطالعه كورير و همكارانش بهدست آمد كه ثابت ميكرد غلظت دو فراورده حاوى نانوذرات در قلب به مقدار قابل توجهى كاهش مييابد، اما هم زمان غلظت دو فراورده فاقد نانوذرات در قلب 17 برابر بوده است. از آنجائيكه استفاده از داكسوروبايسين در قلب به جهت تجمع و اثر سمى بالايى كه دارد با محدوديت مواجه است اين مشاهده بسيار حائز اهميت است.
نانوذرات جامد ليپيد (SLN) هم ميتوانند، بعد از مصرف از طريق داخل وريدى و حتى از طريق دئودنوم(دوازدهه) غلظت قابل توجهى در مغز ايجاد كنند.
غلظت داكسوروبايسين متصل به SLN در مغز mg/kg 6 بعد از 180 دقيقه به ?g/g 2در بافت مغز ميرسد اين در شرايطى است كه بعد از مصرف محلول داكسوروبايسين به تنهايى كه از طريق وريد جوگولار به موش تزرق شد هيچ اثرى از داكسوروبين در مغز پيدا نشد.
انواع مختلفى از نانوذرات جامد ليپيد با اندازهاى حدود 100 نانومتر به وسيلهى لاكمن و كوزيار و همكارانشان ساخته و در جريان خون مغز موش تزريق شد و سپس ميزان جذب آنها بهوسيلهي ساكروز و با استفاده از روشهاى آمارى با هم مقايسه شد و مشاهده گرديد كه اين ذرات توانستهاند بهوسيلهي سيستم اعصاب مركزى دريافت شوند. در عين حال، تزريق نانوذرات هيچ تغييرى در يكپارچگى سد مغزى– خونى و نفوذپذيرى غشاء و يا حتى در انتقال تسهيل شده كولين، ايجاد نكرد.
تومورهاى مغزى
تومورهاى مغزى، مخصوصاً گليوماى بدخيم از تهاجم ىترين سرطانهايى است كه انسان با آن مواجه است. عليرغم پيشرفتهايى كه در فناورى جراحى اعصاب، درمانهاى حمايتى با شيمى درمانى و پرتودرمانى بهدست آمده، اما سير بهبودى در اين بيماران هنوز بسيار ناخوشايند است. از مشخصههاى اين تومورها رشد سريع، انتشار و تهاجم به نقاط دورتر مغز است، علاوهبر اين ورم وسيع مغزى و مقادير زيادى از روند رگ سازى نيز مشاهده ميشود. با وجود اينكه سد مغزى- خونى (BBB) در قسمت هسته و مرده (نكروز) تومور، بهطور واضحى شكسته ميشود ولى اين اتفاق در حاشيه رو به رشد تومور انجام نميپذيرد. به همين دليل داروهاى ضد سرطان از قبيل داكسوروبايسين فقط ميتوانند به قسمت مرده تومور نفوذ كنند و دارو به قسمتهاى محيطي تريا اصلاً نميرسد و يا دسترسى بسيار ناچيزى دارد.
همانطور كه در بالا گفته شد، اين دارو در شرايطى كه به نانوذرات پلى بوتيل سيانو آكريلات متصل باشد ميتواند به سرعت به غلظتى حدود 6 ميكروگرم به ازاء هر گرم در بافت مغز برسد. اين نانوذرات در موشهايى كه در داخل جمجمه آنها تومور گليوبلاستوما 101 پيوند زده شده بود، 101آزمايش شد.
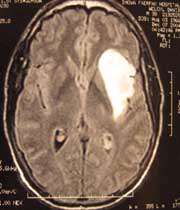
در روزهاى دوم، پنجم و هشتم بعد از پيوند تومور، تركيب [داكسوروبايسين - نانوذرات پلى بوتيل سيانوآكريلات - پلى سوربات 80 ] با دوز1/5mg/kg به موش تزريق شد، در نتيجه متوسط عمر 85 درصد افزايش يافت و با تكرار آن، 20 تا 40 درصد از حيوانات تا 180 روز عمر كردند. سپس حيوانات كشته شدند و در بررس ىهاى بافتشناسى عدم وجود تومورها در اين حيوانات به اثبات رسيد. در مقايسه با گروههاى كنترل يعني [نانوذرات پلى بوتيل سيانوآكريلات - پلى سوربات80 ]، محلول [داكسوروبايسين - نانوذرات پلى بوتيل سيانوآكريلات]، افزايشى در طول عمر و تعداد موشهاى زنده مانده مشاهده نشد و يا بسيار ناچيز بود. هيچ سميتى از نانوذرات در بافتشناسى ديده نشد. همچنين اثر سمى محلول داكسوروبايسين كه معمولاً در ساير دستگاههاى بدن مشاهده ميشود در اتصال با نانوذرات كاهش پيدا كرد.
سازوكار دارورسانى بهوسيلهى نانوذرات از طريق سد خونى- مغزى
در حال حاضر سازوكار دارورسانى بهوسيلهى نانوذرات از طريق BBB بهطور كامل روشن نشده است. اما فرضيههاى متعددى مطرح است كه در ذيل به آنها اشاره ميشود:
1. افزايش نانوذرات در موير گهاى مغز متعاقباً باعث افزايش جذب آنها بهوسيلهى ديوارههاى مويرگ ميشود. اين عمل يك شيب غلظتى ايجاد ميكند و باعث ميشود اين ذرات از جدار سلولهاى آندوتليال عبور كرده و در نهايت به مغز برسد.
2. پلى سوربات 80 در نقشى كه بهعنوان يك روكش براى نانوذرات دارد، ميتواند از سيستم انتشار برگشت، مخصوصاً از عمل پلي گليکوپروتئين. (Pgp) جلوگيرى كند.
3. با اعمال اثر سمى بر روى عروق مغز، باعث افزايش نفوذپذيرى سلولهاى اندوتليال ميشود.
4. يك اثر عمومى مشابه اثر سورفاكتانت، باعث حل شدن ليپيدهاى موجود در غشاء سلولى ميشود و در نتيجه غشاء بهصورت مايع در آمده و باعث افزايش نفوذپذيرى دارو از طريق سد مغزى- خونى ميشود.
5. ذرات نانو ميتوانند يك شكاف در اتصالات فشرده بين سلولهاى اندوتليال ايجاد نمايند. سپس داروها به تنهايى يا بهصورت متصل به ذرات نانو، از آن شكاف عبور ميكنند.
6. ممكن است نانوذرات به روش اندوسيتوز بهوسيلهى سلولهاى اندوتليال بلعيده شوند و سپس داروها در داخل سلولها رها شده و از اين طريق به مغز برسند.
7. ذرات نانو به همراه داروى متصل شده به روش ترانس سيتوز از لايه سلولهاى اندوتليال عبور ميكنند.
8. تمام اين سازوكارها ميتوانند با هم عمل كنند.
سازوكا رهاى 1 و 2 بعيد به نظر ميرسد زيرا: اگر نانوذراتى كه حامل دارو هستند از طريق چسبيدن به ديواره داخلى مويرگ و با ايجاد يك شيب غلظتى بالا عبور كرده باشند (سازوكار 1 )، انتشار دارو هنوز ميتواند در سيطره حاملهاى خارج كننده اى باشد كه در غشاءهاى آندوتليال سلولها وجود دارند. از طرف ديگر، اگر پلى سوربات 80 بتواند اين حاملها را مهار كند (سازوكار 2 )، تزريق نانوذرات با روكش پلى سوربات 80 به تنهايى 5 يا 30 دقيقه قبل از تزريق دالارگين، بايد باعث تسكين درد شود، كه در اين آزمايش مشاهده نشد. اين نظر كه سازوكار 1 و 2 در عمل اتفاق نميافتد، بهوسيلهى مطالعاتى هم كه كوزيارا بر روى مغز انجام داد، تأييد شد.
فرضيههاى 3 و 5 نيز رد مى شوند، زيرا هيچ اثر ضد دردى بعد از تزريق پلى سوربات 80 (فاقد نانوذرات) مشاهده نشد.
علاوه بر اين، هيچ پاسخ ضد دردى بعد از تزريق نانوذرات – دالارگين با روكش سورفاكتانتهاى ديگر بهدست نيامد (سازوكار شماره 4، مايع شدن عمومى غشاء).
اين عقيده كه علت انتقال دارو بهوسيلهى نانوذرات از BBB به جهت ايجاد اثر سمى بر غشاء نيست در مطالعات سان و كوزيرا ثابت شد . پوشاندن تنها قسمتى از نانوذرات بهوسيلهى پلى سوربات 80 براى دارورسانى به مغز كافى است، مطالعات خونرسانى بافتهاى مغز نشان داد كه نانوذرات نميتوانند هيچ تغيير واضحى در يكپارچگى BBB نفوذپذيرى غشاء و يا در سيستم ، انتقال تسهيل شده كولين ايجاد كنند. تئورى ايجاد شكاف در اتصالات فشرده كه اساس سازوكار 5 را تشكيل ميداد بهوسيلهى يافتههايى كه هيچگونه افزايشى را در فضاهاى اينولين نشان نميداد، رد شد، علاوه بر اين، ميكروسكوپ الكترونى هم هيچ شكاف واضحى را در اتصالات فشرده نشان نداد .
بنابراين محتملترين سازوكار، به نظر ميرسد كه سازوكار 6 (دريافت نانوذرات حامل دارو بهوسيلهى اندوسيتوز باشد. اين سازوكار قبلا در محيط آزمايشگاهى با بافتهاى كشت داده شده سلولهاى اندوتليال مغز انسان، گاو، خوك، موش خانگى و موش صحرايى نشان داده شده بود در دماى يكنواخت C 37° ، مشاهده شد كه نانوذراتى كه با پلى سوربات 80 روكش شدهاند با سرعت و بهطور قابل ملاحظهاى بهوسيلهى اين سلولها برداشت ميشوند، در صورتيكه در نمونه بدون روكش بسيار ناچيز بود و در دماى 4°C (دمايى كه در آن فاگوسيتوز انجام نميشود) و يا بعد از مصرف سيتوكالازين B بازدارنده قوى فاگوسيتوز) متوقف شد.
كريتر بعداً نشان داد كه نانوذرات متصل به دالارگين حتى ميتوانند بعد از جذب آپوليپوپروتئينE و B اثرات ضد دردى خود را اعمال نمايند. اين اثر حتى بعد از پروراندن پلى سوربات 80 بسيار افزايش يافت. بنابراين سناريوى زير را ميتوان مطرح كرد: نانوذرات به جهت داشتن روكش پلى سوربات بعد از تزريق در خون ميتوانند آپوليپوپروتئين E و يا B را جذب كنند. پس اين ذرات در نقش ذرات ليپوپروتئين ظاهر شده و بهوسيلهى سلولهاى آندوتليال مغز كه داراى مقادير بسيار زيادى از گيرندههاى ليپوپروتئينى هستند به روش آندوسيتوز وابسته به گيرنده، جذب ميشوند. با توجه به اينكه حاملهاى انتشار دهنده عمدتاً بر روى غشاء لومينال (مجرايى) قرار دارند، دارو ميتواند بعد از رها شدن از ذرات پليمر (اين ذرات بسيار تجزيهپذير هستند)، بهوسيلهى فرايند انتشار به داخل مغز منتقل شود ( 20 ). اگر چه هنوز هيچ مدرك محكمى در دست نيست ولى اين احتمال هم وجود دارد كه نانوذرات بتوانند به روش ترانس سيتوز(سازوكار 7 ) از سلولهاى اندوتليال عبور كنند. بنابراين به نظر ميرسد كه ذرات نانو، نقش « اسب تروا» را در اينجا ايفاء ميكنند.
اين فرضيه كه دارو از طريق آندوسيتوز نانوذرات به اين سلولها ارائه ميشود بهوسيلهى سان، كوزيرا و گسنر تأييد شده است. از آنجائيكه گيرندههاى ليپوپروتئين بهوضوح در تومورهاى مغزى وجود دارند ، سناريوى پيشنهادى بالا، عمل متقابل گيرندههاى ليپوپروتئين و اثربخشى تركيب [پلى سوربات 80 – داكسوروبايسين – ذرات نانو] را به خوبى نشان ميدهد.
نتيجهگيرى
نانوذرات پلى سيانوآكريلات يا نانوذرات جامد ليپيد قادر هستند، بسيارى از داروهاى ضرورى را كه در شرايط معمولى نميتوانند از سد مغزى - خونى عبور كنند، از اين مسير منتقل نمايند. از نانوذرات همچنين ميتوان براى رساندن تركيبات بزرگتر و مولكولهاى پيچيدهتراز قبيل پروتئينها، اسيدهاى نوكلئيك و ژنها براى گذشتن BBB از استفاده كرد. آنها حتى ميتوانند باعث بهبودى در درمان تومورهاى مغزى شوند چرا كه با اتصال نانوذرات روكش شده با پلى سوربات 80 ميتوان داروهاى ضد تومور را از سد نفوذ ناپذير BBB ،عبور داد. در نتيجه م ىتوان به مكانهايى كه براى اكثر داروهاى ضد سرطان دور از دسترس است، دست يافت.
اگر چه سازوكار انتقال نانوذرات حامل دارو از BBB هنوز كاملاً روشن نشده است، اما به نظر ميرسد كه بعد از تزريق به جريان خون و اتصال با آپوليپوپروتئينها، ابتدا به سلولهاى اندوتليال مويرگهاى مغز متصل ميشوند و به دنبال آن از طريق اندوسيتوز (با واسطه گيرنده ها) وارد سلولهاى اندوتليال ميشوند. اين محتملترين اسب » سازوكار مطرح است. بنابراين نانوذرات مانند «اسب تروا» عمل ميكند كه ميتواند داروها را در داخل اين سلولها و يا بعد از ترانس سيتوز، به داخل مغز رها كند.